Gel protein có vai trò đặc biệt quan trọng trong ngành công nghiệp thực phẩm, đặc biệt là trong việc tạo cấu trúc của các sản phẩm. Bài viết này, chúng ta cùng tìm hiểu về gel protein, cơ chế, điều kiện và các yếu tố ảnh hưởng đến quá trình.
Gel protein
Khi protein bị biến tính các cấu trúc bậc cao bị phá huỷ, liên kết giữa các phần tử bị đứt, các nhóm bên của acid amin trước ẩn ở phía trong thì bây giờ xuất hiện ra ngoài. Các mạch polypeptide bị duỗi ra, gần nhau, tiếp xúc với nhau và liên kết lại với nhau thành mạng lưới không gian ba chiều mà mỗi vị trí tiếp xúc của mạch lạ một nút. Các phần còn lại hình thành mạng lưới không gian vô định hình, rắn, trong đó có chứa đầy pha phân tán là nước.
Cơ chế và các tương tác có quan hệ đến việc hình thành mạng protein ba chiều đặc trưng cho gel hiện chưa hoàn toàn rõ. Nhiều nghiên cứu đã chỉ rõ rằng cần phải có giai đoạn biến tính và giãn mạch xảy ra trước giai đoạn tương tạo trật tự giữa protein – protein và tập hợp phân tử.
 Khi nồng độ tăng thì khả năng gel hoá tăng vì số những vị trí tiếp xúc để tạo ra nút mạng lưới tăng lên. Nồng độ protein càng lớn thì các hạt tiếp xúc trực tiếp không qua một lớp nào của của môi trường phân tán và khối gel càng dề vì ở những vị trí đặc biệt ở đầu mút, những góc cạnh các yếu tố bền dễ bị mất do đó dễ tạo ra nút mạng lưới.
Khi nồng độ tăng thì khả năng gel hoá tăng vì số những vị trí tiếp xúc để tạo ra nút mạng lưới tăng lên. Nồng độ protein càng lớn thì các hạt tiếp xúc trực tiếp không qua một lớp nào của của môi trường phân tán và khối gel càng dề vì ở những vị trí đặc biệt ở đầu mút, những góc cạnh các yếu tố bền dễ bị mất do đó dễ tạo ra nút mạng lưới.
Các nút mạng lưới có thể được tạo ra do tương tác giữa các nhóm ưa béo. Khi các nhóm này gần nhau, tương tác với nhau thì hình thành ra liên kết ưa béo, lúc này các phân tử nước bao quanh chúng bị đẩy ra và chúng có khuynh hướng như tụ lại. Tương tác ưa béo được tăng cường khi tăng nhiệt độ, làm các mạch polypeptide sát lại với nhau hơn do đó làm cho khối gel cứng hơn.
Nút mạng lưới cũng có thể được tạo ra do các liên kết hydro giữa các nhóm peptide với nhau, giữa các nhóm – OH của serin, treonin hoặc tirozin với các nhóm – COOH của glutamic hoặc của aspactic. Nhiệt độ càng thấp thì liên kết hydro càng được tăng cường và củng cố vì lúc này có điều kiện để tạo ra nhiều cầu hydro. Liên kết hydro là liên kết yếu, tạo ra một độ linh động nào đó giữa các phân tử đối với nhau, do đó làm cho gel có một độ dẻo nhất định. Các mắt lưới trong gel gelatin chủ yếu là do các liên kết hydro. Khi gia nhiệt các liên kết hydro bị đứt và gel sẽ nóng chảy ra. Khi để nguội liên kết tái hợp và gel lại hình thành.
Tham gia tạo ra các nút lưới trong gel cũng có thể do các liên kết tĩnh điện, liên kết cầu nối giữa các nhóm tĩnh điện ngược dấu hoặc do liên kết giữa các nhóm tĩnh điện cùng dấu qua các ion đa hoá trị như ion canxi chẳng hạn. Các mắt lưới còn có thể do các liên kết đisulfua taon nên. Trong trường hợp này sẽ tạo cho gel có tính bất thuận nghịch bởi nhiệt, rất chắc và bền.
Một số protein có bản chất khác nhau có thể tạo gel khi được đun nóng đồng thời (sự đồng tạo gel). Các protein cũng có thể tạo gel bằng cách cho tương tác với các chất đồng tạo gel như các polysacarit, làm thành cầu nối giữa các hạt do đó gel tạo ra có độ cứng và độ đàn hồi cao hơn. Cũng có thể them các chất alginate hay pectinat tích điện âm vào gelatin tích điện dương để tạo ra tương tác ion không đặc hiệu giữa các chuỗi peptit do đó sẽ tao cho gel có nhiệt độ nóng chảy cao (80oC).
Người ta cũng thường thêm caraghenat polysulfat (tích điện âm) vào sữa (pH của sữa) để tạo ra ion tương tác đặc hiệu với vùng tích điện dương casein K. Vì thế mà các mixen casein có thể được chứa trong các gel caraghenat.
Khối gel mới tạo thành còn chứa một lượng lớn nước ở phía trong. Nhiều gel có thể chứa tới 98% nước. Ngoài lớp nước hydrat hoá liên kết chặt chẽ với các nhóm có cực của chuỗi protein, còn co nước ở dạng dng môi tự do. Người ta nhận thấy, mặc dù nước bị nhốt này có tính chất giống như nước của một dung dịch muối loãng được giữ bằng lực vật lý, vẫn không thể bị đầy ra một cách dễ dàng. Có thể là khi tạo gel đã tạo ra một cái bẫy để nhốt nước. Hoặc cũng có thể các lỗ của mạng lưới protein giữ được nước dạng mao quản.
Khi đi từ dung dịch nước protein, các giai đoạn đầu của quá trình tạo gel bằng nhiệt có thể như sau (phương trình (*):
- Phân li thuận nghịch cấu trúc bậc bốn thành các dưới đơn vị hoặc monomer.
- Biến tính không thuận nghịch các cấu trúc bậc hai và ba (sự giãn mạch vẫn còn là từng phần).
Người ta thấy, trạng thái gel cuối cùng tương ứng với các tập hợp protein từng phần bị biến tính (PD)x, (x < n) nên có thể là phương trình (**) hoặc (***):
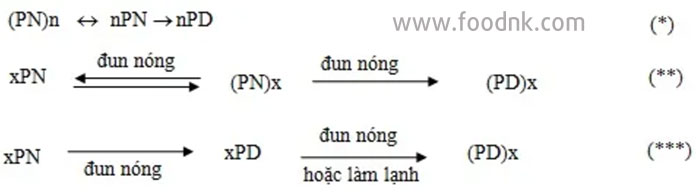
Phần đầu của phương trình (**) là phản ứng kết tụ, phần thứ hai của phương trình (**) là phản ứng đông tụ khô. Trong điều kiện thuận lợi cho biến tính hơn là cho tập hợp (protein mang điện tích lứn ở pH thấp hoặc cao, lực ion rất yếu, có mặt số ion, có mặt các tác nhân phân ly như: ure, guanidin, các chất tẩy rửa) thì sự đun nóng sẽ làm xảy ra phản ứng theo phương trình (***).
Giai đoạn tập hợp càng chậm so với giai đoạn biến tính thì càng có điều kiện để các mạch polypeptit đã được giãn mạch ra từng phần, sẽ có trật tự, đồng đều, trơn, trương mạnh, rất đàn hồi và trong suốt; gel bền, không bị co tách dịch. Ngược lại các gel được tạo thành từ các tiểu phần protein có tập hợp thô sẽ đục, ít đàn hồi và đặc biệt không bền (gel bị co và dễ chảy dịch).
Sự giãn mạch các phân tử protein sẽ làm xuất hiện các nhóm phản ứng nhất là các nhóm kỵ nước (ưa béo) của protein hình cầu. Do đó các tương tác kỵ nước giữa protein – protein sẽ thuận lợi và là nguyên nhân chính của việc tạo tập hợp liên tục. Các protein có khối lượng phân tử cao và có tỷ lệ phần trăm acid amin kỵ nước cao sẽ tạo gel có mạng lưới chắc. Khi ở nhiệt độ cao các tương tác ưa béo sẽ thuận lợi trong khi đó sự hình thành các liên kết hydro lại dễ dàng khi làm lạnh. Sự gia nhiệt cũng có thể làm phơi bày các nhóm – SH ở bên trong, do đó xúc tiến việc hình thành hoặc trao đổi các cầu đisulfua. Khi có mặt nhiều nhóm – SH và –S-S – sẽ tăng cường hệ thống mạng giữa các phân tử và gel tạo ra bền với nhiệt. Các cầu canxi lam cho gel có độ cứng và độ bền tốt hơn.
Vùng pH thuận lợi cho sự tạo gel sẽ được mở rộng cùng với sự tăng nồng độ protein. Vì khi ở nồng độ protein cao thì các liên kết ưa béo và liên kết disulfua có điều kiện để tạo thành sẽ bù trừ lại các lực đẩy tĩnh điện cảm ứng vốn do protein tích điện cao sinh ra.
Ở điểm đẳng điện do vắng mặt các lực đẩy nên gel tạo ta kém phồng, ngậm ít nước và cứng. Các protein có tỷ lệ acid amin ưa béo cao (trên 31,5% số phân tử) như hemoglobin, ovalbumin, sẽ có vùng pH tạo gel thay đổi phụ thuộc vào nồng độ protein. Trái lại các protein có phần trăm các acid amin ưa béo thấp (22÷31%) như γ – globulin, serumalbumin, gelatin và protein của đậu tương… thì lại không thay đổi pH tạo gel khi nồng độ protein thay đổi.
Điều kiện tạo gel
Trong phần lớn các trường hợp, gia nhiệt là cần thiết cho việc tạo gel. Đôi khi cũng có thể làm lạnh bên trong hoặc acid hóa nhẹ. Cho thêm muối đặc biệt là ion Ca2+ có thể cần thiết để làm tăng tốc độ tạo gel hoặc tăng độ cứng của gel (đối với trường hợp protein đậu nành, lactoserum, serum albumin).
Nhiều protein có thể tạo gel mà không cần đun nóng, chỉ nhờ thủy phân nhẹ bằng enzyme (mixen casein, lòng trắng trứng, fibrin), đơn giản là có thể cho thêm Ca2+ (mixen casein) hay từ môi trường kiềm đưa về pH trung tính hoặc pI đẳng điện.
Trong khi nhiều gel được hình thành từ protein trong dung dịch, một số hệ phân tán trong nước hoặc dung dịch muối ăn của protein ít hoặc không tan trong nước cũng có thể tạo thành gel. Như vậy, tính tan của protein không phải lúc nào cũng cần thiết cho sự tạo gel.
Sự gia nhiệt, trong đa số trường hợp là rất cần thiết cho quá trình tạo gel. Việc làm lạnh sau đó cũng cần thiết và đôi khi một sự acid hoá nhẹ nhàng cũng có ích. Thêm muối (đặc biệt là ion canxi) có thể cũng cần, hoặc là để tăng tốc độ tạo gel hoặc để gia tăng độ cứng cho gel.
Nhiều gel cũng có thể được tạo ra từ protein dịch thể (lòng trắng trứng, dịch đậu tương), từ các thể protein không tan hoặc ít tan phân tán trong nước hoặc trong muối (collagen, protein tơ cơ, isolate (dịch đậm đặc) đậu tương) từng phần hoặc toàn bộ bị biến tính. Như vậy độ hoà tan của protein không phải luôn luôn cần thiết cho sự tạo gel.
Yếu tố ảnh hưởng đến gel
- Nhiệt độ: nhiệt độ thấp → tạo nhiều liên kết hydro ⇒ gel bền hơn.
- Acid hóa hoặc kiềm hóa nhẹ → pH ≈ pI ⇒ gel tạo thành chắc hơn.
- Các chất đồng tạo gel như các polysaccharide làm cầu nối giữa các hạt ⇒ gel có độ cứng và độ đàn hồi cao hơn.
FOODNK